| Главная | ||||
| Advertisements | ||||
| Фармацевтические технологии и упаковка | ||||
| Медтехника. Лекарства, изделия медназначения. Дезсредства | ||||
| Стоматолог-практик | ||||
| Статьи Фармацевтические технологии и упаковка - Лекарства по GMP | ||||
| Статьи Медтехника. Лекарства, изделия медназначения. Дезсредства | ||||
| Подписка | ||||
| Рекламодателям | ||||
| Контакты | ||||
Проведение анализа рисков при проектировании и валидации фармацевтического производства, О.Р.Спицкий, ООО «ННЕ Фармаплан»
Проведение анализа рисков при проектировании и валидации
ведущий специалист по валидации и квалификации, ООО «ННЕ Фармаплан», Москва Исследование, анализ и учет рисков используется давно в различных областях, например, при оценке надежности и безопасности в промышленности и технике, в бизнес-планировании, экономическом прогнозировании и др. В фармацевтическом производстве подходы, основанные на оценке рисков, получили наиболее широкое применение в отношении рисков для качества лекарственных средств. Хотя р иск качества является лишь одним из компонентов общего риска при производстве лекарственных препаратов, он рассматривается как наиболее существенный для здоровья и безопасности пациентов. В последние годы наблюдается тенденция изменения статуса подхода, основанного на анализе рисков, когда эти принципы постепенно переходят из области актуальных тенденций в разряд обязательных требований. Так, Агентство FDA США в 2004 году в своей новой концепции «Правила GMP в XXI веке» обозначило анализ рисков как основу для определения критических факторов в отношении качества при проведении инспектирования. В 2005 году было принято трехстороннее руководство ICH - документ Q9 «Управление рисками качества», а с марта 2008 года он включен в качестве приложения (№ 20) в Правила GMP Европейского Сообщества. Правила GMP представляют собой свод теоретических и практических требований к планированию, выполнению и документированию мер по обеспечению качества, но степень влияния этих мер на качество продукции не оценивается и не учитывается. Однако очевидно, что это влияние может быть различным для разных продуктов и разных конкретных производств. Кроме того, невозможно предусмотреть и закрепить в виде требований все разнообразные варианты и проблемы, возникающие как на стадии проектирования производств, так и в процессе производства лекарственных средств. Поэтому необходим механизм, который позволял бы заранее оценивать влияние на качество продуктов различных компонентов, систем, процедур и мероприятий и степень этого влияния, и таким образом продуманно учитывать и планировать выполнение требований GMP , а также предупредительных и корректирующих мероприятий. В качестве такого механизма как раз может использоваться анализ рисков. В этом смысле использование подходов, основанных на оценке и анализе рисков, можно считать дальнейшим развитием стандартов качества, задаваемых Правилами GMP . В упоминаемом выше руководстве ICH Q9 изложены два основных принципа управления рисками качества:
Такое сочетание научного и рационального принципов позволяет определить подход, основанный на оценке рисков, как весьма эффективный и обоснованный инструмент управления качества. В Правилах GMP имеется лишь краткое указание на использование подхода, основанного на оценке рисков,: «Для определения состава и объема работ по валидации следует использовать подход, основанный на оценке рисков» (Приложение 15, п.1) . Н и в основном тексте, ни в приложениях Правил GMP нет описания подходов и методов проведения и документирования, и до выхода документа Q9 не было другого руководства или рекомендаций, в которых более подробно были описаны методы и инструменты оценки рисков для качества при разработке и производстве лекарств. Поэтому на практике использовались методы и инструменты анализа рисков, более детально разработанные в других стандартах и документах. Из них наиболее широко применяются методы, содержащиеся в стандартах по анализу видов, последствий и критичности отказов в технике ( FMECA , FMEA ) и в стандарте безопасности пищевых продуктов ( HACCP ). Поэтому документ Q9 не содержит описания конкретных инструментов, а опирается на уже хорошо разработанные и оправдавшие себя подходы. Цели и задачи управления рисками Управление рисками качества и подходы, основанные на оценке рисков, могут использоваться для выполнения разных задач. Поэтому в первую очередь должны быть определены цели проводения такого анализа. В области фармпроизводства можно сформулировать, например, следующие цели: • Избежание или снижение потенциального ущерба для качества ЛС • Управление системой качества • Выбор критических параметров • Принятие решения в случае отклонений • Оптимальное использование ресурсов • «Страхование» рисков Избежание ущерба для качества представляет собой главную цель управления рисками качества; цель и задача анализа рисков при управлении системой качества может возникнуть для расстановки приоритетов в развитии этой системы или устранении недостатков, т.е. что необходимо делать в первую очередь, а что – потом. Другие частные цели, такие как принятие решения или выбор критических параметров могут ставиться при выполнении или проведении отдельных мероприятий, таких как валидация, выбор поставщика, принятие решения в случае отклонений от качества и т.д. Как правило, последние две цели, т.е. анализ рисков для определения оптимального использования ресурсов и страхование риска требует количественной или по крайней мере полуколичественной оценки. В документе ICH Q9 подробно рассматриваются области применения управления рисками качества (см. таблицу 1). Разумеется, эти области связаны с вышеупомянутыми целями, и можно установить, какие из названных целей преследуются в той или иной области применения управления рисками. Таблица 1
Процесс управления рисками Чтобы рассмотреть последовательность проведения анализа рисков, можно руководствоваться схемой управления рисками качества, приведенной в документе ICH Q9. 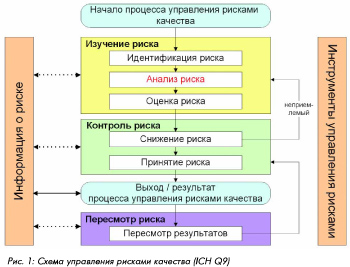
В соответствии с этой схемой процесс управления рисками может быть представлен следующим образом:
Изучение возможных рисков для отдельных компонентов и системы относится к стадии идентификации риска. Для процесса должно быть составлено описание по стадиям и операциям или приведена блок-схема с указанием стадий и критических факторов (см. пример на рис. 2); для оборудования или систем должно быть приведено описание с перечислением компонентов (и/или приложены необходимы схемы). Для четкой идентификации рисков в процессе их изучения могут помочь три фундаментальных вопроса: 1. Что может пойти неправильно? 2. Какова вероятность, что это пойдет неправильно? 3. Каковы могут быть последствия (тяжесть)? 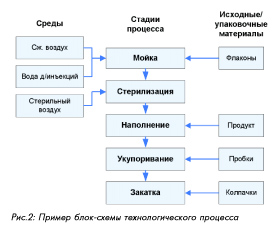
Как правило, идентификация рисков в процессе производства лекарственных средств должна охватывать следующие аспекты: · Состояние помещений и гигиена · Потоки персонала и материалов · Окружающие условия · Спецификации на критические материалы · Технические аспекты функционирования оборудования · Поведение продукта (физические свойства, контакт с окружающей средой и оборудованием и др.) На этой стадии изучения рисков должна использоваться вся имеющаяся информация (документация по процессам, оборудованию, продуктам, проектная документация, эмпирические сведения и опыт на основе аналогичных объектов). В данном случае очень важна достоверность и обширность изучения исходных данных, поэтому наиболее надежные результаты могут быть получены предпочтительно за счет привлечения опытных специалистов из соответствующих областей. В сложных случаях полезно использовать метод экспертной оценки, при этом также важна квалификация и опыт привлекаемых экспертов. Анализ и оценка критичности рисков , как правило, включает определение величины риска на основании анализа вероятности и тяжести вреда для качества. При этом для GMP -рисков (качественная оценка) достаточно анализа того, существует ли угроза нарушения требований GMP ; в любом случае должно прослеживаться влияние на качество продукта. При необходимости количественной оценки должны использоваться методы и подходы, учитывающие величину вероятности, тяжести и (дополнительно) возможности обнаружения вреда или ущерба. Для качества и надежности результата важна достоверность данных, поэтому большое значение здесь также приобретает опыт экспертов в данной области. В сложных случаях можно использовать метод экспертной оценки. Поскольку анализ и оценка рисков предполагает возможность или необходимость проверки, то в документации на данной стадии полезно приводить пояснение или обоснование оценки критичности риска, чтобы не возникало разногласий или непонимания при коммуникации и проведении проверок и инспекций. Для многих задач применения анализ и оценка рисков является окончательной стадией, дающей требуемый результат. Примерами таких задач являются, например, планирование валидации, выбор оборудования и систем, оценка поставщиков и др. Определение мер по предотвращению или снижению риска относится к стадии контроля рисков. Контроль подразумевает 1) измерение уровня параметра, характеризующего риск (опасного фактора), и 2) управление риском, т.е. принятие меро по его снижению или предотвращению. Поэтому для идентификации и измерения опасного фактора должны быть указаны возможные контрольные признаки, позволяющие качественно или количественно протестировать этот фактор. Для этих контрольных признаков должны быть определены критерии приемлемости, в пределах которых риск считается допустимым. Методы контроля, предусмотренные для данного риска на данной стадии, рассматриваются как предупреждающие действия в отношении риска, поэтому они также указываются как часть стадии контроля рисков. Все же по характеру действия их можно определить как пассивные методы контроля рисков. Напротив, меры по снижению или избежанию риска, если он выходит за допустимые пределы, являются активными методами контроля рисков. При разработке этих мер необходимо придерживаться следующих принципов:
Использование результатов и документирование В качестве результата процесса управления рисками может выступать как действие, так и информация, полученные на любой стадии, в зависимости от поставленной цели. Например, для выбора критических параметров или принятия решения достаточно информации, полученной после проведения изучения рисков (например, для целей валидации процесса). Для предупреждения ущерба, расчета ресурсов, страхования рисков требуется проведение всего процесса управления рисками, включая предупреждающие действия. Этап изучения рисков документируется в отдельном документе, либо может быть включен в качестве раздела в основной документ, для которого было предназначено проведение анализа рисков (например, в план или протокол валидации процесса). Информирование о рисках и пересмотр При выполнении корректирующих и предупредительных мероприятий, а также в случае изменений в систему могут быть внесены новые риски, или могут измениться существующие. Поэтому следует проводить пересмотр оценки рисков после выполнения таких действий и изменений. Информирование о рисках может проводиться на любой стадии управления рисками между любыми заинтересованными сторонами. Периодичность пересмотра (обзора) должна определяться уровнем риска. Пересмотр рисков может быть включен в стандартные существующие процедуры обзора и пересмотра, такие как самоинспекции, контроль изменений, обзор качества, тренд-анализы и др. Проведение и документирование анализа рисков Наиболее важными и распространенными областями применения подходов, основанных на оценке и анализе рисков, являются проектирование производства ЛС и валидация. В случае валидации важность оценки рисков определяется необходимостью получения обоснованного подтверждения пригодности процедур или оборудования для получения качественного продукта. Это может быть сделано только при выборе для валидационных проверок важных критических параметров и контрольных точек. В общем жизненном цикле валидации, показанном на рис.3, можно выделить моменты, когда необходимо проведение анализа рисков (указаны стрелками). Это требуется при разработке мастер-плана валидации, а затем в начале квалификации оборудования (до стадии DQ ) и при планировании валидации очистки и валидации процесса. 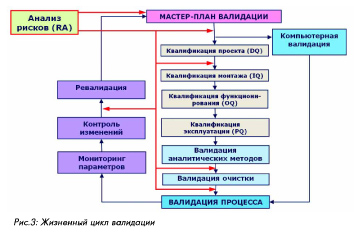
Для проведения валидации процесса должны быть определены при помощи анализа рисков и задокументированы в протоколе валидации критические стадии и операции процесса и контролируемые параметры для них. Результатом анализа рисков при этом является указание контрольных точек и параметров, которые должны быть протестированы в процессе валидации. То есть для целей валидации процесса результат получается после стадии анализа и оценки рисков, поэтому документирование может быть проведено в виде следующей таблицы (2): Таблица 2
Если же необходимо проведение анализа рисков в полном объеме, как это требуется, например, для квалификации оборудования, то в ННЕ Фармаплан разработана и используется следующая форма представления результатов (таблица 3), отражающая все стадии управления рисками (изучение, контроль, пересмотр). Таблица 3
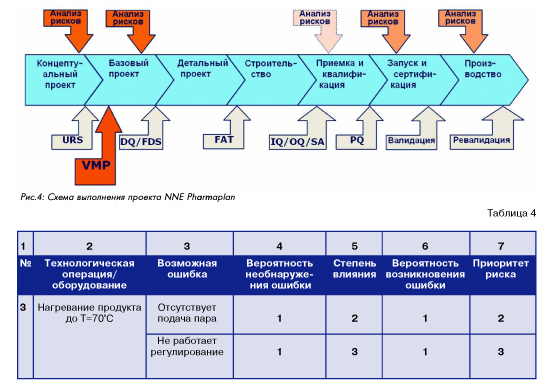
Для получения количественных результатов при анализе и оценке рисков часто используется известный метод анализа видов, последствий (и критичности) отказов FMEA ( FMECA ), изложенный в стандарте МЭК 60812, в соответствии с приведенной ниже таблицей (4). При этом шкала критериев [4], [5], [6] обычно устанавливается в интервале от 1 до 3 – 10 баллов, а приоритет риска [7] рассчитывается как произведение [4] x [5] x [6]. Этот критерий количественной оценки риска соответствует пункту D анализа рисков GMP , где дается только качественная оценка. Таблица 4
При проектировании фармацевтического производства роль подхода, основанного на оценке рисков, очень важна. Должны быть учтены все относящиеся к проекту требования GMP , но как правило всегда остается поле выбора различных вариантов, удовлетворяющих этим требованиям. Для выбора оптимального варианта с учетом возможных рисков требуется поэтому анализ рисков. От решений, принятых на ранних стадиях проектирования (концептуальный и базовый проект) в решающей степени зависит как стоимость реализации проекта, так и стоимость исправления неучтенных ошибок и отклонений. На рис. … показана модель реализации проектов, используемая в NNE Pharmaplan , вместе с выполнением сопутствующих мероприятий и составления документации по валидации и квалификации. Как видно на этой схеме, в процессе выполнения и реализации проекта анализ рисков может проводиться неоднократно; при этом наиболее полный и ответственный анализ рисков проводится на стадии концептуального проектирования (базовый анализ рисков – по проекту в целом) и базового проектирования (детальный анализ рисков – по отдельным единицам оборудования и инженерным системам). Проведение и документирование такого анализа рисков выполняется в соответствии с приведенной выше таблицей (3). В заключение можно сформулировать общую схему анализа и управления рисками качества в виде последовательности действий:
1. Определение объекта и цели исследования рисков 2. Выбор методов (инструментов) анализа рисков 3. Распределение ответственности (подготовка документации и вопросов, предоставление информации, оценка рисков, предложение и согласование корректирующих мероприятий, документирование, принятие решения) 4. Проведение изучения рисков и документирование 5. Согласование результатов изучения и корректирующих мероприятий 6. Использование информации о рисках (если требуется) 7. Принятие решения по результатам изучения (если требуется) 8. Осуществление деятельности с учетом контрольных мер и корректирующих мероприятий 9. Пересмотр рисков при изменении условий или наступлении события Эффективный анализ рисков предполагает сочетание формализованного подхода и эмпирических методов (ICH Q9). При правильном использовании он может служить как эффективный инструмент, который позволяет выявить источники рисков и наиболее критические факторы, оценить и предотвратить возможные проблемы, сэкономить ресурсы и достичь более высокого качества. Очень важно при этом наличие опыта и практики, которые позволяют, с одной стороны, использовать проверенные и отработанные схемы и подходы, а с другой стороны – взвешенно и продуманно подходить к их применению в каждом конкретном случае. Компания ННЕ Фармаплан имеет многолетний опыт и отработанные методы применения анализа рисков при проектировании новых или расширении существующих производств, квалификации и валидации действующих производств, которые успешно используются при выполнении инжиниринговых и консалтинговых проектов в фармацевтической и биотехнологической отрасли.
Контактная информация
Факс (499) 766 9651
www.nnepharmaplan.com |
| Дизайн webing.ru |
 О.Р.Спицкий,
О.Р.Спицкий,