| Главная | ||||
| Advertisements | ||||
| Фармацевтические технологии и упаковка | ||||
| Медтехника. Лекарства, изделия медназначения. Дезсредства | ||||
| Стоматолог-практик | ||||
| Статьи Фармацевтические технологии и упаковка - Лекарства по GMP | ||||
| Статьи Медтехника. Лекарства, изделия медназначения. Дезсредства | ||||
| Подписка | ||||
| Рекламодателям | ||||
| Контакты | ||||
Методические основы определения качества воды очищенной по микробиологическим показателям
- А.Е.Приходько, ЗАО «НПК Медиана-Фильтр» - О.В.Гунар, Институт контроля лекарственных средств ФГУ НЦ ЭСМП
Вода очищенная - это вода, используемая фармацевтическими предприятиями, больничными и межбольничными аптеками для производства и/или изготовления лекарственных средств, растворения или разведения субстанций, а также в других целях при получении нестерильных лекарственных препаратов. Вопросы микробиологического качества воды в настоящее время обозначены достаточно остро. Это связано прежде всего с несовершенством методической базы, а также отсутствием современного оборудования предварительной подготовки, получения, хранения и распределения воды на производстве и в аптеках, отвечающего всем требованиям.
Оценка общего числа микроорганизмов позволяет определить численность разнообразных групп микроорганизмов, способных образовывать колонии на питательном агаре, оценить уровень микробного загрязнения воды. Данный показатель весьма чувствителен к увеличению в воде легкоусвояемых органических веществ, поэтому динамика возрастания сапрофитной микрофлоры, особенно по сравнению с ее численностью в поступающей воде, характеризует санитарное состояние отдельных стадий водоподготовки.
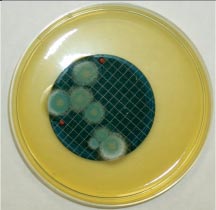
Общее микробное число является косвенным показателем, так как характеризует общее содержание микроорганизмов в воде без их качественной характеристики. Размножение сапрофитной микрофлоры в системе предварительной подготовки воды для фармацевтических целей может явиться причиной вторичного загрязнения воды. При этом накопление биомассы создает дополнительные условия для размножения индикаторных, условно-патогенных и патогенных микроорганизмов. Особое значение данный показатель приобретает при ежедневном контроле качества воды в одной и той же точке. Внезапное возрастание общего микробного числа (даже в пределах нормы) является сигналом для поиска причины загрязнения. В основе микробиологического контроля воды очищенной лежат методы мембранной фильтрации и прямого посева. В 1 мл воды очищенной (ангро) допускается не более 100 аэробных бактерий. В 100 мл не допускается наличие E.coli и P.aeruginosa. Отбор проб. Для достоверности результатов пробу воды целесообразно отбирать непосредственно из пробоотборного крана (пробоотборника) без полимерных (силиконовых и пр.) шлангов и насадок. Первоначально место отбора (кран или место подсоединения шланга) с помощью распылителя обрабатывают 70% этиловым спиртом, в некоторых случаях (пробоотборник из нержавеющей стали) используют фламбирование с помощью спиртовки. Сливают воду до 10 л воды при полностью открытом кране. Затем отбирают пробу для микробиологического испытания в стерильную емкость в количестве не менее 1л. Воду испытывают на наличие колиформных бактерий, синегнойной палочки, определяют общее число аэробных бактерий. Микробиологический анализ. Для определения общего числа аэробных бактерий образец тестируемой воды тщательно перемешивают и вносят по 1мл в две стерильные чашки Петри. В каждую добавляют по 8-10 мл расплавленной и охлажденной до 45о С среды №1 (Государственная Фармакопея XI изд., вып.2). Содержимое чашек быстро перемешивают и оставляют до застывания. После застывания чашки переворачивают и инкубируют в течение 24ч при температуре (32,5 +2,5)о С. Подсчитывают все выросшие колонии. Результат выражают средним числом КОЕ в 1 мл исследуемой пробы воды. Для определения колиформных бактерий проводят мембранную фильтрацию, используя стерильные фильтры с диаметром пор 0,45 мкм. Для получения достоверных результатов проводят 3-х кратную мембранную фильтрацию по 100 мл воды. После чего фильтры переносят на заранее разлитый по чашкам Петри агар Эндо (среда № 4). Если анализируемая вода стабильно соответствует нормативам, допустима фильтрация 300 мл воды через один фильтр. Для положительного контроля среды используют посев тест-микроорганизма Escherichia coli АТСС 25922 на агар Эндо. Чашки Петри с фильтрами инкубируют в течение 24ч при температуре (32,5 +2,5)о С. Результат считается отрицательным, если на фильтрах не выросли колонии или колонии имеют нетипичный вид (неровные края, шероховатая поверхность). Если отмечается рост колоний: темно-красных, красных с металлическим блеском, с красным центром, выпуклых, блестящих, подсчитывают число колоний каждого типа и проводят идентификацию. Для этого каждую колонию микроскопируют и при выявлении грамотрицательных палочек отсевают на скошенную среду № 1 для получения чистой культуры. В качестве подтверждающих тестов используют оксидазный тест, образование кислоты и газа при ферментации глюкозы (среда № 6) , редукцию нитратов в нитриты с использованием реактива Грисса (среда № 7). Таким образом, полученные грамотрицательные палочки, не обладающие ферментом цитохромоксидаза, ферментирующие глюкозу и редуцирующие нитраты, относятся к общим колиформным бактериям и их наличие в питьевой воде недопустимо. Особое внимание следует уделить синегнойной палочке (Pseudomonas aeruginosa). Для ее достоверного выделения проводят 3-х кратную мембранную фильтрацию по 100 мл очищенной воды, после чего фильтры переносят на заранее разлитую в чашки Петри среду №9 (цетримидный агар). Если анализируемая вода стабильно соответствует нормативам, то допустима фильтрация 300 мл воды через один фильтр. Для положительного контроля среды используют посев тест-микроорганизмов P. aeruginosa АТСС 9027 на среду №9 (цетримидный агар). Чашки Петри с фильтрами инкубируют в течение 72 ч при температуре (32,5 +2,5)о С. Результат считается отрицательным, если на фильтрах вообще не выросли колонии или колонии имеют нетипичный вид. Если отмечается рост зеленоватых, голубо-зеленых, флюоресцирующих колоний, их идентифицируют. В качестве подтверждающих тестов используют окраску по Граму, цитохромоксидазную реакцию и рост при 42о С в течение 48-72ч. Выделенные микроорганизмы относятся к P. aeruginosa при наличии сине-зеленого пигмента–пиоционина, грамотрицательной окраске, положительной цитохромоксидазной реакции и росте на питательной среде при 42о С в течение 48-72ч. В связи с высокой значимостью показателя «Микробиологическая чистота» для оценки качества воды для фармацевтических целей, нами были проведены комплексные исследования образцов воды очищенной, полученной в одной из больничных аптек г. Москвы. Образцы воды были отобраны как непосредственно после финишной стадии очистки, так и в системе ее хранения и распределения. Выполненные нами исследования показали неутешительные результаты, представленные на фотографиях. Во всех образцах были обнаружены аэробные бактерии, дрожжевые и плесневые грибы, кишечные бактерии после мембранной фильтрации образцов (см. фото). Мембраны на соответствующих питательных средах инкубировали в течение 3-4 суток при температуре (32,5 +2,5)о С (для учета бактерий) и (22,5 +2,5)о С (для учета грибов). При подготовке и проведении микробиологических исследований необходимо помнить, что на качество результатов во время анализов воды могут существенно влиять следующие факторы: · квалификация персонала, выполняющего отбор проб, посев образцов па питательные среды, учет и интерпретацию результатов; · сроки хранения отобранных проб воды; · условия проведения испытания (температура и время инкубации посевов); · правильный учет и интерпретация результатов; · валидация процессов мембранной фильтрации и прямого посева; · использование качественных питательных сред.
Таким образом, был сделан неутешительный вывод о том, какую же воду наши аптеки (и, к сожалению, предприятия тоже) используют для изготовления и/или производства лекарственных средств, и какие лекарственные препараты принимают пациенты стационаров, да и мы с Вами. А что говорить о регионах Российской Федерации, если даже в г. Москве наши медицинские учреждения не в состоянии обеспечить надлежащего качества воды для фармацевтических целей и «вооружиться» современным технологическим оборудованием.
Все-таки, что же нужно, чтобы микробиологическая чистота не вызывала никаких сомнений? В первую очередь, необходимо внедрять и использовать современное технологическое оборудование и техническое обеспечение; правильно выбрать технологическую схему предварительной подготовки, получения, хранения и распределения воды для фармацевтических целей в соответствии с потребностями предприятия или аптеки. Для этого и существуют узкопрофильные компании такие, например, как ЗАО «НПК Медиана-Фильтр», имеющие практический и теоретический опыт и обладающие штатом высококвалифицированных и профессиональных специалистов, т.е. необходимо «отдать все в руки профессионалов».
И безусловно, необходимо реанимировать и воссоздать нормативную базу, внедрить государственную программу контроля качества воды в аптечных и фармацевтических учреждениях на местах, а также периодического контроля и мониторинга воды уполномоченными независимыми организациями. |
| Дизайн webing.ru |
 Основными потенциальными источниками микроорганизмов в воде для фармацевтических целей на фармацевтическом предприятии или в аптеке являются источник воды и используемое оборудование. Присутствующие в исходной питьевой воде микроорганизмы могут адсорбироваться и задерживаться фильтрами с активированным углем, многослойными фильтрами, ионообменными смолами, мембранными элементами, микро- и ультрафильтрами, инициируя образование биопленок. Системы вентиляции (отсутствие защиты и/или неисправность фильтров), обратный ток воды из систем канализации, воздушные зазоры сливных устройств так же могут служить источником микроорганизмов. Часто причиной микробной контаминации является замена фильтрующих сред (активированного угля, ионообменных смол и др.) Микроорганизмы могут «прикрепляться» к взвешенным в воде частицам, например, угольной пыли, и становиться причиной контаминации следующего далее оборудования водоподготовки.
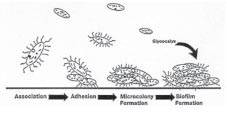
Основными потенциальными источниками микроорганизмов в воде для фармацевтических целей на фармацевтическом предприятии или в аптеке являются источник воды и используемое оборудование. Присутствующие в исходной питьевой воде микроорганизмы могут адсорбироваться и задерживаться фильтрами с активированным углем, многослойными фильтрами, ионообменными смолами, мембранными элементами, микро- и ультрафильтрами, инициируя образование биопленок. Системы вентиляции (отсутствие защиты и/или неисправность фильтров), обратный ток воды из систем канализации, воздушные зазоры сливных устройств так же могут служить источником микроорганизмов. Часто причиной микробной контаминации является замена фильтрующих сред (активированного угля, ионообменных смол и др.) Микроорганизмы могут «прикрепляться» к взвешенным в воде частицам, например, угольной пыли, и становиться причиной контаминации следующего далее оборудования водоподготовки. Другим источником бактериального загрязнения является система хранения и распределения ВО и ВДИ, При неправильно спроектированной системе и отсутствии периодической санитарной обработки трубопроводов и накопительных емкостей может происходить рост на внутренних поверхностях труб, вентилей, соединительных элементов, в застойных зонах. Это становится причиной образования биопленок, являющихся постоянным источником микробиологического загрязнения. Микроорганизмы в биопленках защищены от воздействия многих биоцидных агентов. Сорванные с места первичного образования и перенесенные в другое место биопленки становятся источниками микроорганизмов далее по ходу движения воды.
Другим источником бактериального загрязнения является система хранения и распределения ВО и ВДИ, При неправильно спроектированной системе и отсутствии периодической санитарной обработки трубопроводов и накопительных емкостей может происходить рост на внутренних поверхностях труб, вентилей, соединительных элементов, в застойных зонах. Это становится причиной образования биопленок, являющихся постоянным источником микробиологического загрязнения. Микроорганизмы в биопленках защищены от воздействия многих биоцидных агентов. Сорванные с места первичного образования и перенесенные в другое место биопленки становятся источниками микроорганизмов далее по ходу движения воды. 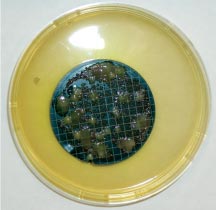 Основными бактериальными показателями загрязнения воды являются: сапрофитные бактерии, указывающие на поступление в воду легко разлагающихся органических веществ; бактерии – обитатели кишечника человека и теплокровных животных, указывающие на загрязнение воды фекальными и хозяйственно-бытовыми отбросами.
Основными бактериальными показателями загрязнения воды являются: сапрофитные бактерии, указывающие на поступление в воду легко разлагающихся органических веществ; бактерии – обитатели кишечника человека и теплокровных животных, указывающие на загрязнение воды фекальными и хозяйственно-бытовыми отбросами.